「初学 放射線物理学 ワークブック」検索番号 A13 の穴埋め解答例と解説です。
先に自分で穴を埋めてみてからの答え合わせでも良いですし、解答例を写してから覚えていっても良いです。ご自分に合ったスタイルで取り組んでください。
目次
さっそく解答例
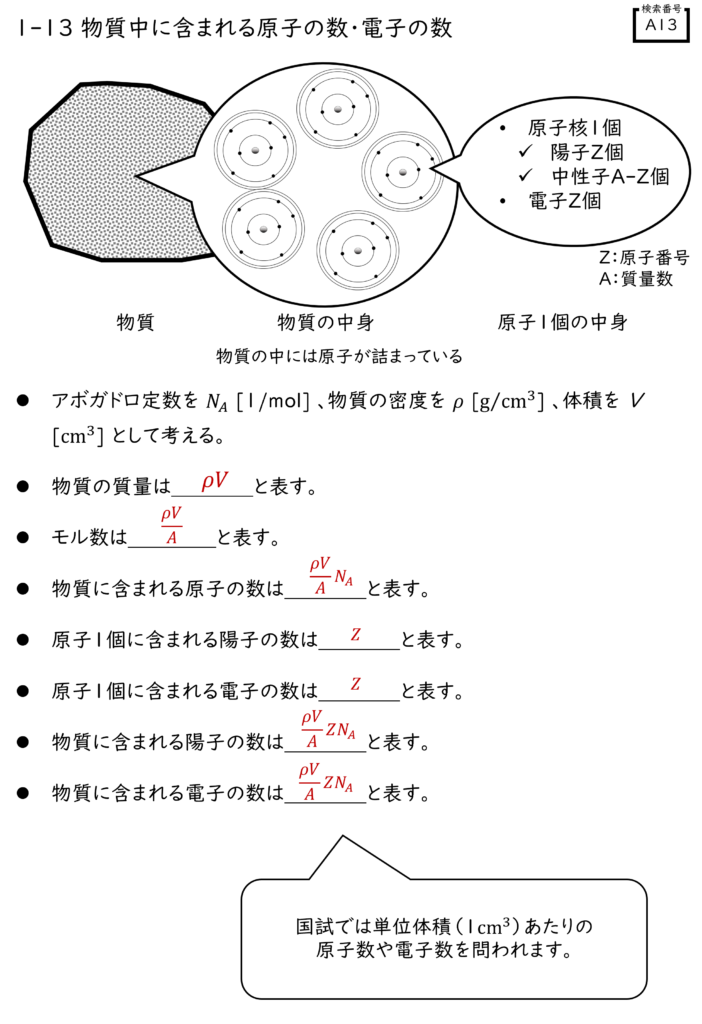
解説
ここは学生からも質問の多い分野です。
中学校で習う知識もチョコっと使ってます。
でも大丈夫。
単位を考えていけば組み立てられますよ。
それでは、イってみましょう。
まずは文字の定義から
ここで登場する文字を一気に定義付けしていきましょう。
順不同です。思いついたものからあげていきます。
- NA:アボガドロ数 [1/mol]
- ρ:物質の密度 [g/cm3]
- V:物質の体積 [cm3]
- A:質量数
- Z:原子番号
馴染みのない方の為にちょっと用語の解説を挟んでおきましょう。
アボガドロ数
単位をよく見て下さい。
アボガドロ数の単位は [1/mol] です。1の部分を個にして [個/mol] としても良いです。
(単位の世界で「1」は「個数」や「回数」を表すときに使われます。)
これは、「物質が1mol集まったら、そこには何個の原子がありますよ」ということを示しています。
数字で表すと、6.02×1023個です。
つまり、物質が1molあると、その物質の中に原子が6.02×1023個入っているということになります。
物質の密度
こちらも単位をよく見て下さい。
密度の単位は [g/cm3] です。
これは1cm3の体積あたりの質量を示しています。
SI基本単位で示すと[kg/m3]となりますが、常用されるのは[g/cm3]です。
要は、どれだけギュッと詰まっているかを示しています。
当然、密度が高ければギュッと詰まっていて、密度が低ければスカスカということになります。
見かけ以上に重たいなってものは高密度です。鉛なんかが良い例ですね。
反対に大きくても軽い発泡スチロールは低密度と言えますね。
物質の体積

物質(物体)の大きさを示したものですね。
単位をみると、 [m3] となっています。
これは [m] を3回掛け算してねという意味でしたよね。
つまり、長さを3回掛ければOKですね。
サイコロ状の物体であれば、「縦」×「横」×「高さ」ですね。
質量数と原子番号

説明の必要はないかもしれませんが、念のため。
質量数は原子核の中にある核子の総数です。
簡単に言うと、「陽子」と「中性子」の合計数です。
それに対して原子番号は「陽子」の数です。
物質の質量はどう表す?
問題文中に質量が明記されていれば問題ありません。
その数字や文字を使ってください。
だいたい「m」が充てられることが多い印象です。
問題は明記のない場合です。
質量の明記がない場合は、何とかして質量を表現しなくてはなりません。
ここでも単位が役に立ちます。
質量の単位は [kg] ですが、原子のような小さいものの場合は [g] で良いでしょう。
先ほど定義した文字の中から、単位をよく見て組み合わせれば、質量が表現できそうではないですか?
えっ?できない?
2文字組み合わせると・・・
密度と体積の単位を組み合わせて見て下さい。
ρ[g/cm3] と V[cm3] です。
掛け算してみると、 [g] になりますよね。
質量は密度と体積の積で表すことができます。
モル数はどう表す?
厳密にいえば「モル質量」ということになりますが、放物では「モル数」で差支えないでしょう。
また、本来は「原子量」に当たる部分も「質量数」で考えて差し支えありません。
放物でだけですよ。
従いまして、物質に含まれるモル数は「質量」mを「質量数」Aで除せば求められます。
質量が定義・明記されていない場合は、密度と体積を駆使して表現します。

こちらの知恵袋も参考になります。
是非ご一読ください。
物資中に含まれる原子の数はどう表す?
モル数とアボガドロ数の積で表現することができます。
モル数は物質の中に何mol入っているか。
アボガドロ数は1molあたりに原子がいくつ入っているかを示していましたね。
したがって、この2つを掛け合わせることによって、物資中に含まれる原子の数を表すことができるようになります。

原子1個に含まれる陽子数と電子数


原子の構造を思い出してください。
原子の中心には原子核があり、その中に陽子が入っています。
原子核の周りを軌道電子が周回しています。
電気的に偏りのない中性原子においては、陽子と軌道電子の数は等しいんでしたよね?
(特にイオン化しているなどの断りがない限りは中性原子として扱います。)
詳しくはこちらの記事もご参照ください。

ひとつの原子の中で陽子数を表すものがありましたね?
覚えてますか?
そう、原子番号でしたね。
つまり、1つの原子に含まれている陽子数は軌道電子の数と等しく、それは原子番号で表すことができます。
物質に含まれる陽子数と電子数
最終的にコレが求めたいのです。
物質の中にいったい何個の電子や原子が含まれているのか?
すでに物質中に含まれる原子の数は表せますね?
念のために確認する

そこにもう1つ! 原子の中に含まれる電子数の表現を加味すれば・・・

となります。
実際の問題を見てみよう
国試ではこんな感じで出題されました。

いきなり電子数を問われると、「えっ?分かんない・・・」ってなてしまいがち。
でも大丈夫。いままでのプロセスをたどって考えていけば解けます。
答えを確認する。
第66回 4
できましたか?
解説
物質の中に含まれる電子数を問われていますから、物質中の原子数と原子番号の積で表現できます。
この問題では体積が1cm3となっているのがひっかけ要素ですね。

上式のVに1を代入して表せばOKです。
まとめ

いきなり最後の答えを出すのではなく、細かく刻んで考えて見て下さい。
知っている知識を組み合わせれば、答えにたどり着きますよ。
お願い
本サイトに掲載されている図やイラストの著作権は管理人にあります。
無断掲載や転載はお断りさせていただきます。
また、リンクフリーではありますが、画像などへの直リンクはお控えください。
