電子配置の表は、数字が並んでいてややこしい感じがしますよね。
表自体を試験で書けと言われることは多くはありませんが、表を理解していないと解けない問題は結構見かけます。
この記事では、電子配列のルールをマスターし、表を自分で再現できるようになることが目標です。
実際には、大きな紙を用意して、N殻あたりまで書き出す練習をすることで、自然と身につけていきます。
殻ごとの電子数には規則性があるため、何度か練習すれば暗記ではなくパターンとして理解でき、試験でも迷わず書けるようになりますよ。
理解のベースは量子数
この記事は量子数を把握してから読んだ方が何倍も理解が深まります。
量子数ってなんだっけ?
という場合はA22:量子数とは?4種類の意味とパウリの排他原理をご参照ください。

軌道電子の配置表を書けるようになろう
電子がどの殻にどれだけ入るのか――これは「とにかく暗記しなきゃ」と思われがちですが、きちんとしたルールがあります。殻の番号を n としたとき、その殻に収容できる最大の電子数は 2n² で表されます。
※ここでの n は主量子数のことです。覚えてましたよね?
- K殻(n=1) → 2×1²=2個
- L殻(n=2) → 2×2²=8個
- M殻(n=3) → 2×3²=18個
- N殻(n=4) → 2×4²=32個
このように「2、8、18、32…」と順番に増えていきます。
ここまで理解しておけば、電子配置の表を自分の力で再現する土台ができます。
殻ごとの収容数を整理する
ここ、覚えにくくてかなわんわぁ。
なんか良い方法ないんか?


いきなり殻に収容される最大数を覚えようとするからだよ。
規則性を紐解いていこう。
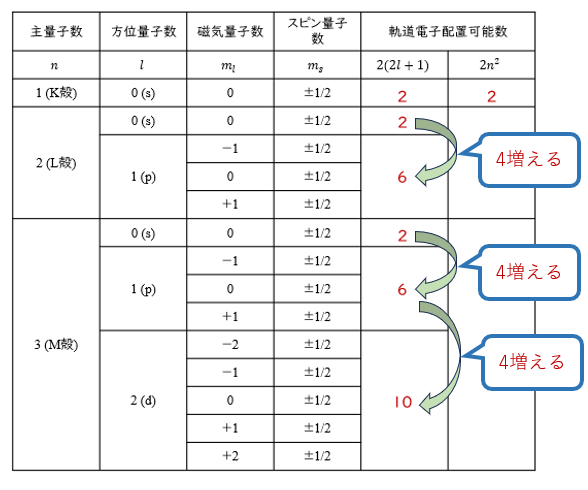
この表を見てみると、1s軌道には2個、2s軌道には2個で2p軌道には6個、同様に3s軌道は2個・3p軌道は6個・3d軌道には10個の軌道電子が収容されていくことが分かりますよね。
s軌道、p軌道、d軌道と副殻が増えていくにつれ、収容される軌道電子の数は4個ずつ増えていくようになっています。
それには、磁気量子数が関わっています。
s軌道の磁気量子数は0の1種類だけだから軌道電子は2個、p軌道は磁気量子数が-1・0・1の3種類に分かれるから6個、d軌道は磁気量子数が-2・-1・0・1・2の5種類に分かれるから10個になります。
つまり、方位量子数が1増えるごとに磁気量子数は2つ増えるから、収容される軌道電子は4個増えることになります。
この表も参考にしてみてください。
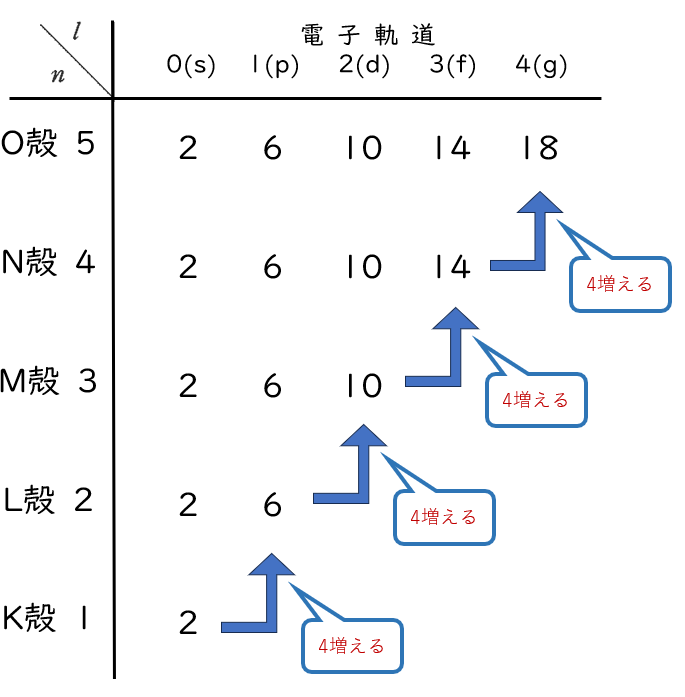
s軌道はK殻だろうがL殻だろうがM殻だろうが絶対に2個までしか入らない。
p軌道も同様に最大で6個。d軌道も何殻だろうが10個までしか入らない。

どうかな?
気付いてしまえば簡単な法則でしょう?
N殻までしっかり練習してみよう
N殻(最大32個)は国家試験レベルではフルに問われることは少ないですが、K殻からN殻までしっかり書けると理解度がぐっと深まります。
練習のときは大きめの紙にK殻から順に並べて、「外側にいくほど収容数が急に増える」 ことを視覚的に確認すると覚えやすいです。
書いて覚えると何が見えるようになる?
表を繰り返し手で書いていくと、「ただの暗記」から一歩進んで、周期表とのつながりが見えてきます。
- 第2周期 → L殻までで原子番号10(ネオン)まで
- 第3周期 → M殻が関わって原子番号18(アルゴン)まで
- 第4周期以降 → N殻が登場
このように、電子配置を理解することは周期表の並びを理解することにもつながります。
つまり「表を書ける」こと自体が、周期表を理解するためにも一役買っていることになります。
試験に出る!軌道電子配置の重要ポイント
軌道電子の配置は、国家試験でもかなり高確率で出題されるテーマです。
単に「表を書けるかどうか」を問うだけでなく、周期表や元素の性質とからめて出題されることも多いので、しっかり押さえておく必要があります。
覚えるだけじゃなく「規則性」を意識する
試験問題では「3d軌道には最大で何個の電子が入るか」や「ある元素の最外殻電子の数はいくつか」といった問いがよく出ます。
ここで大事なのは、ただ丸暗記した数字を並べるのではなく、2n²則や軌道の収容数のルールを理解しておくことです。
3d軌道は最大いくつか
軌道にはそれぞれ収容できる電子の上限があります。
- s軌道:2個
- p軌道:6個
- d軌道:10個
- f軌道:14個
したがって「3d軌道」には 最大10個 の電子が入ります。
これは「d軌道には5つの部屋(磁気量子数の違い)があり、それぞれに2個ずつ入る」と考えると覚えやすいです。
最外殻電子の数はいくつか
元素の性質を決めるのは最外殻にある電子の数です。
例えばカルシウム(原子番号20)の場合は K殻から順に、2、 8、 8、 2 という配置になり、最外殻電子はN殻に2個。
ここからカルシウムが周期表の第2族(アルカリ土類金属)に属することが理解できます。
このように、単なる暗記ではなく「軌道の種類ごとの上限」と「最外殻電子数」に注目することで、出題形式が少し変わっても慌てずに対応できるようになります。
確かに過去問で2p軌道の電子数を聞かれてた記憶あんで。


牛助、よく覚えてたね。
少し古い問題だけど、確かに出てるんだ。
後で紹介しようね。
配置と周期表・化学的性質のつながり
電子配置は「ただの数字」ではなく、周期表の並び方や元素の性質を理解するカギになります。
周期表の横の並び(周期)
原子番号が1つ進むごとに電子が1つ増え、外殻に順番に入っていきます。たとえば第2周期なら、リチウム(2,1)から始まり、ベリリウム(2,2)、…と進んで、ネオン(2,8)で殻がいっぱいになる。この「横に進むと最外殻電子が増えていく」流れが周期の正体です。
周期表の縦の並び(族)
縦に並ぶ元素は「最外殻電子の数」が共通しています。ナトリウム(2,8,1)もカリウム(2,8,8,1)も最外殻電子は1個なので、同じアルカリ金属に分類され、似たような性質(反応性が強い、イオンになりやすい)を示します。
医療系のつながり
元素の性質を決める最外殻電子は、放射線との相互作用にも関係します。
X線撮影で「造影剤にヨウ素が使われる理由」も、ヨウ素の電子配置によって光電効果を起こしやすい殻構造を持っているからです。
このように電子配置を知っていると、周期表や化学だけでなく医療現場での実際の現象にも説明がつくようにいなります。
実際の問題を見ていきましょう
ちょっと古いけどスタンダードな問題をご紹介しましょう。
第65回 2013年 問42
基底状態にある ${}_{10}\mathrm{Ne}$ の2p軌道に配置される電子数はどれか。
- 2
- 4
- 6
- 8
- 10
解答を確認する。
正解は 3 です。
- ネオン(Ne)の原子番号は10なので、電子数も10個です。
- 電子配置は
1s² 2s² 2p⁶
となります。
この表記は「1s軌道に2個、2s軌道に2個、3p軌道に6個配置されているよ」という意味です。 - 2p軌道には最大6個まで電子を収容できます。ネオンはちょうど2p軌道までがいっぱいに埋まっており、2p軌道に入っている電子は6個です。
このように、「p軌道は最大で6個(3つの部屋×2個)」というルールを覚えておけば、落ち着いて解けますね。
医療現場での関わり
電子配置の細かい数字を、医療現場でそのまま使うことはほとんどありません。
けれども、電子がどう配置されているかを理解することは、放射線や薬剤が物質にどう作用するのかを考えるうえで基礎になります。
- 放射線と電子殻
X線撮影やCTで重要になるのは、光電効果やコンプトン散乱といった相互作用です。これらは「どの殻の電子がはじき出されるか」で強さが決まります。たとえば内殻電子が関与すると、特性X線が放出され、画像コントラストに影響を与えます。 - 造影剤の働き
ヨウ素やバリウムのように「原子番号が大きい元素」が造影剤に使われるのも、電子配置の影響です。内殻に多くの電子を持つことで、X線を吸収しやすく、血管や消化管をはっきり描出できます。 - 原子番号と安定性
最外殻電子の数は、元素の安定性や化学的性質を決めます。これが薬剤の結合や代謝に影響するため、電子配置の理解は「化学の基礎を知っているかどうか」に直結しています。
つまり、電子配置を自分で書ける力は直接現場で使う道具ではありませんが、放射線の相互作用や造影剤の働きを理解する下地として欠かせない知識なのです。
まとめ
軌道電子の配置は、最初は「数字を覚えるだけの作業」に見えるかもしれません。ですが、2n²則に基づく規則性を意識すれば、ただの暗記ではなく「なぜそうなるのか」を理解できるようになります。
- 殻ごとの収容数(2, 8, 18, 32…)を整理して覚える
- 軌道の種類(s, p, d, f)ごとの上限(2, 6, 10, 14)を押さえる
- 周期表や化学的性質とのつながりを意識する
この3つをセットで理解すれば、試験問題にもスムーズに対応できるはずです。

表を丸暗記するんじゃなくて、規則性を理解するのが大事だよ。
自分で書けるようになるまで練習すれば、自然と頭に残るから安心してね。
次に読むならコレ!電爺的おすすめ内部リンク

ほれ、ここまで読んだんなら、次はこのあたりを見ておくとえぇぞい。

第76回のPM70の解説をぜひご一読ください。
手前味噌ですが、分かりやすいですよ。
自分で言うんかいっ!

もっと知りたい方へ!たまのすけおすすめ外部リンク

ここまで読んできた皆さんなら、もう一歩踏み込んだ知識に触れてみたくなるはずです。そんな方におすすめの外部リンクを紹介しますね。



コメント